Tumore über die Aktivierung der körpereigenen Immunabwehr bekämpfen – diesem Ziel ist das BMBF-geförderte Forschungsteam TurbiCAR mit seinem neuartigen Therapiekonzept ein großes Stück nähergekommen. Das zeigt die erfolgreiche erste klinische Prüfung.
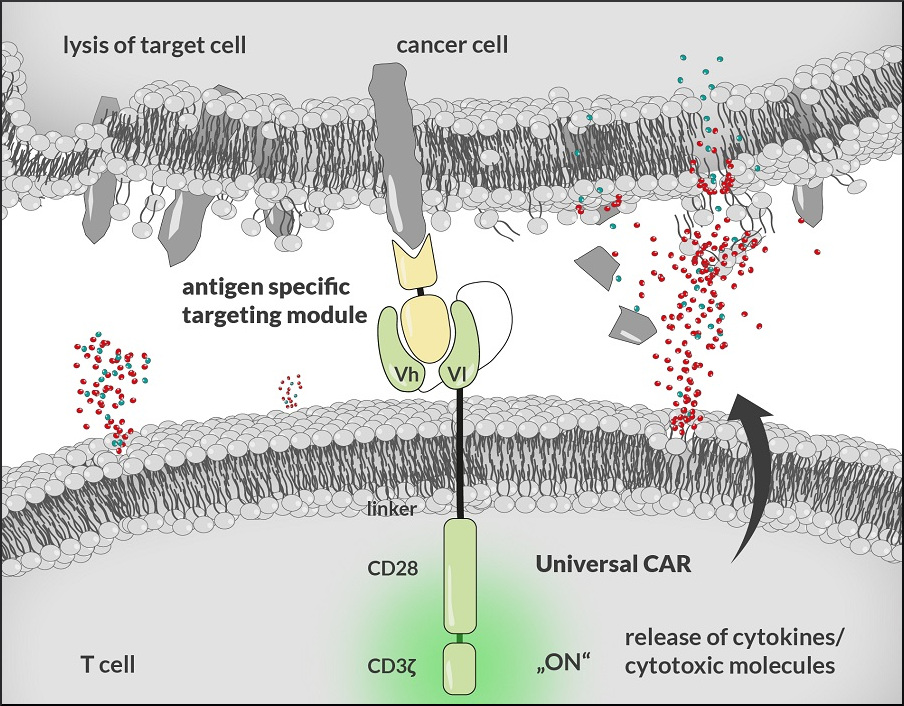
Das einzigartige zweistufige Therapiekonzept von TurbiCAR: Eine Immunzelle (T-Zelle, unten) wird mit UniCAR modifiziert, so dass sie die Krebszelle (oben) abtöten kann; aktiviert wird die modifizierte Abwehrzelle aber erst durch ein Molekül (Mitte), das die spezifischen Antigene (cancer specific antigen) der Krebszellen identifiziert.
AvenCell
Die Idee, Mechanismen des körpereigenen Immunsystems für die Bekämpfung von Tumoren zu nutzen, ist nicht neu – entsprechende Verfahren werden weltweit erprobt. Bei der CAR-T-Zelltherapie wird ein CAR, ein sogenannter chimärer Antigenrezeptor, in das Genom menschlicher Abwehrzellen (T-Zellen) eingebracht. Dieser Rezeptor kann gezielt an Tumorzellen binden und sie zerstören. Ein nicht gewünschter Effekt dieses Therapiekonzeptes: Der Rezeptor kann auch an gesunde Abwehrzellen andocken, wenn sie ähnliche Oberflächenmerkmale wie die Krebszellen haben. Dadurch können starke Nebenwirkungen auftreten, an denen die behandelten Personen im schlimmsten Fall sterben.
Etappenziel erreicht und sogar Rückbildung von Tumoren bewirkt
Das Forschungsteam TurbiCAR um Professor Dr. Michael Bachmann verfolgt einen anderen Weg, und der führte nun zu bemerkenswerten Erfolgen, die auch international große Beachtung finden. So war von Anfang an bei der Entwicklung des UniCAR Systems das Ziel, neben einer steuerbaren Wirkung eine erhöhte Sicherheit bei der Anwendung der gentechnisch veränderter Zellen, also einen Sicherheitsschalter einzubauen, um eventuell durch die gentechnische Veränderung auftretende entartete CAR-T-Zellen erkennen und zerstören zu können. In der ersten klinischen Studie an erkrankten Menschen (Phase-I-Studie), hat das Prüfpräparat jetzt seine neuartige Funktionsweise wie erhofft entfaltet und dabei keine schwerwiegenden Nebenwirkungen hervorgerufen. Zudem gab es erste Nachweise dafür, dass sich die Anzahl der Krebszellen verringerte und sich Tumore tatsächlich zurückbildeten. „Wir arbeiten seit rund zwei Jahrzehnten an unserem Therapiekonzept, und diese Ergebnisse sind eine ganz entscheidende Bestätigung, dass wir damit richtig liegen“, sagt Bachmann, Direktor des Instituts für Radiopharmazeutische Krebsforschung am Helmholtz-Zentrum Dresden Rossendorf (HZDR). Das Bundesministerium für Bildung und Forschung (BMBF) förderte TurbiCAR im Zeitraum 2016 - 2023 mit insgesamt drei Millionen Euro.
Therapiekonzept mit einzigartigem Baukastenprinzip
Das Therapiekonzept von TurbiCAR ist aus zwei Gründen einzigartig. Zum einen bekämpfen die genetisch veränderten Immunzellen keine bestimmte Krebsart und sind daher universell einsetzbar – daher nennt die Forschungsgruppe sie UniCAR-T-Zellen. Der zweite Grund: „Mit UniCAR modifizierte T-Zellen können die Tumorzellen erst durch die Gabe von sogenannten Zielmodulen abtöten“, erklärt Bachmann. Die Zielmodule sind Moleküle, die sich an die Oberfläche derjenigen Tumorzellen binden, die das jeweils passende Antigenprofil aufweisen und so für die UniCAR-T-Zellen als geeignetes Ziel markieren. Für die Therapie werden zunächst die mit UniCAR munitionierten Abwehrzellen verabreicht und dann per Infusion die Zielmodule. Sollten sich Nebenwirkungen einstellen, also fälschlicherweise gesunde Zellen angegriffen oder eine überschießende Immunantwort im Patienten hervorgerufen werden, wird die Infusion der Zielmodule und damit auch die Aktivität der UniCAR-T-Zellen gestoppt. Erst wenn die Nebenwirkungen abgeklungen sind, wird die Therapie per Infusion fortgesetzt.
Erfolg durch Kooperation von Forschung und Unternehmen
„Ein großer Vorteil für die erfolgreiche Umsetzung dieses herausfordernden Projektes einer Übertragung akademischer Forschungsergebnisse in eine klinische Studie, „from bench to bedside“ sozusagen, war die enge strategische Kooperation der beteiligten Partner aus der öffentlich geförderten Grundlagenforschung und den Biotechnologieunternehmen“, erklärt Dr. Marc Cartellieri von der AvenCell Europe GmbH Dresden, dem Sponsor der klinischen Studie. Bachmanns Fazit: „Ich bin optimistisch, dass Krebs-Patientinnen und -Patienten von diesem Engagement schon bald direkt profitieren werden. Darüber hinaus werden die klinischen Erfahrungen auch umgekehrt, also vom Krankenbett zurück ins Labor, zur Entwicklung noch sicherer und verbesserter Therapieoptionen von Krebspatienten beitragen.“
Die Klinische Phase I-Prüfung ist der erste Test eines Therapieverfahrens oder eines Wirkstoffs am Menschen und darf erst durchgeführt werden, wenn Effektivität und Sicherheit im Labor und wenn erforderlich, in Tierversuchen nachgewiesen wurden. Für Therapieverfahren gegen Krebs wird die Prüfung schwer erkrankten Menschen, die sonst keine Aussicht auf Heilung haben, angeboten, und diese können freiwillig teilnehmen. Wichtigstes Ziel dieser Prüfung ist, die Funktionsweise, die Sicherheit und die Verträglichkeit von Wirkstoffen nachzuweisen, während die Wirksamkeit gegen die Erkrankung erst in der Phase II umfänglich geprüft wird. Da bei TurbiCAR insgesamt 14 an Akuter Myeloischer Leukämie (AML) erkrankte Personen teilnahmen, konnten – neben Erfüllung aller erforderlichen Prüfkriterien – auch erste vielversprechende Erfolge der Wirksamkeit nachgewiesen werden.