Bisher sind Augenerkrankungen, bei denen die Netzhautzellen absterben, nicht heilbar. Eine mögliche zukünftige Behandlung für Betroffene liegt in der Transplantation gesunder Zellen. Dies ist Forschenden nun im Tiermodell gelungen.
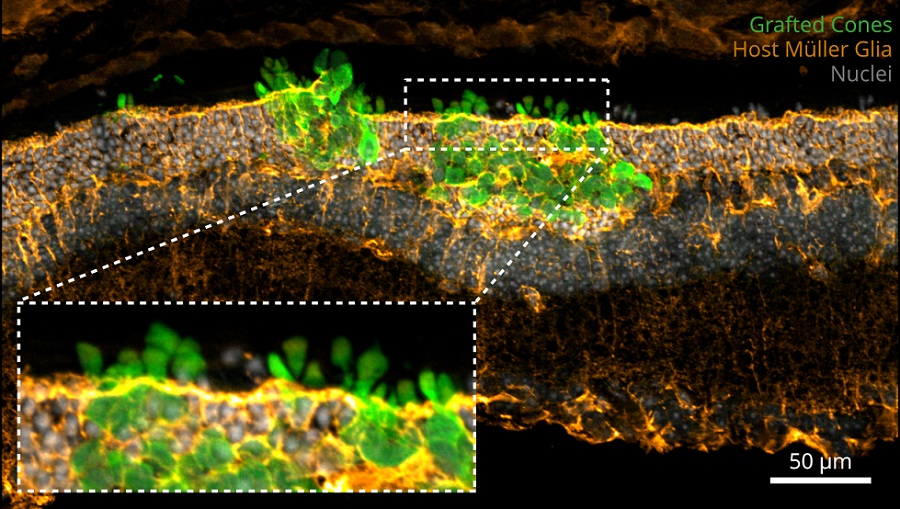
Die Aufnahme zeigt, dass sich die transplantierten Sehzellen (grüne Zapfen) erfolgreich in das noch verbliebene Netzhautgewebe des Empfängers integriert haben.
Ader Lab/CRTD
Über zwei Millionen Menschen müssen allein in Deutschland damit rechnen, dass sie erblinden. Grund dafür sind eine ausgeprägte altersbedingte Makuladegeneration (AMD) oder eine Retinitis Pigmentosa (RP). Beide Erkrankungen entstehen durch unwiederbringliche Schäden an der Netzhaut – dem Anteil unseres Auges, der eine Schlüsselrolle beim Sehen spielt. „Seit über 20 Jahren versucht die Wissenschaft Verfahren zu finden, die verloren gegangenen lichtempfindlichen Zellen der Netzhaut durch Transplantation gesunder Zellen zu ersetzen – bislang mit mäßigem Erfolg“, berichtet Professor Marius Ader von der Technischen Universität Dresden. Der Neurobiologe leitet das Forschungsprojekt ReSight, das durch das Bundesministerium für Bildung und Forschung (BMBF) gefördert wird.
Den wohl entscheidenden Grund für die bisherigen Misserfolge hatte die Wissenschaft schon vor einigen Jahre herausgefunden und Aders Arbeitsgruppe war daran maßgeblich beteiligt: Die Ersatzzellen wurden zwar nicht abgestoßen, aber auch nicht fest im vorhandenen Empfängergewebe verankert. „Damit stellte sich grundsätzlich die Frage, ob man Sehzellen überhaupt ersetzen kann“, erklärt Ader.
Nun ist ihm gemeinsam mit seinem ReSight-Team ein Durchbruch gelungen: Die Forschenden entwickelten ein Verfahren, mit dessen Hilfe Ersatzzellen in ausreichender Menge und Qualität gezüchtet und stabil in das noch verbliebene Netzhautgewebe integriert werden können. „Noch sind unsere Arbeiten auf Tiermodelle beschränkt. Sie ebnen aber den Weg für eine mögliche Zellersatztherapie beim Menschen, mit der die teilweise Wiederherstellung der Sehkraft bei Erkrankungen wie AMD oder RP künftig machbar erscheint“, sagt Ader.
Transplantierbare Zellen und ganze Organoide hergestellt

Professor Dr. Marius Ader
TUD/Magdalena Gonciarz
Voraussetzung für eine Transplantation sind geeignete Ersatzzellen. Hierfür nutzen die Forschenden künstlich induzierte Stammzellen. Diese verfügen – wie natürliche, pluripotente Stammzellen – über die Fähigkeit, sich in jede Zellart weiterzuentwickeln. „Die Herausforderung für uns bestand darin, eine ausreichende Anzahl an Sehzellen zu erhalten, die für eine erfolgreiche Transplantation erforderlich ist“, erklärt Ader. Dem ReSight-Partner Professor Mike Karl gelang es, Retinazellen in großen Mengen herzustellen sowie dreidimensionale Netzhaut-Organoide in der Zellkulturschale wachsen zu lassen, die eine große Anzahl an Sehzellen enthalten.
Hierbei ist es wichtig, Suspensionen mit einer großen Anzahl der gewünschten Sehzellen zu gewinnen. Netzhaut-Organoide, die aus induziert-pluripotenten Stammzellen hergestellt werden, enthalten aber neben dem gewünschten Zelltyp noch viele weitere Zellarten. Eine Aufreinigung ist daher unabdingbar. Bei den bisherigen Experimenten wurden mittels eines gentechnischen Eingriffs die Sehzellen durch einen Farbstoff sichtbar und somit sortierbar gemacht. Eine solche genetische Veränderung der Spenderzellen ist aber für die Anwendung in der Klinik nicht wünschenswert. Die ReSight-Partner von Miltenyi Biotech und die Arbeitsgruppe von Professor Karl optimierten deshalb das Herstellungsverfahren und entwickeln derzeit eine Sortiertechnik, welche die jeweiligen Zellen an ihrer Oberflächenbeschaffenheit erkennt und entsprechend klassifiziert und separiert. „Die Methode ist nicht grundsätzlich auf Netzhautzellen beschränkt, sondern könnte auch bei anderen Zellkulturen zur Qualitätskontrolle anhand der jeweiligen Oberflächensignatur der Zellen genutzt werden“, ergänzt Ader.
Altersbedingte Makuladegeneration und Retinitis Pigmentosa
Bei der Altersbedingten Makuladegeneration (AMD) sind hauptsächlich Sehzellen (Zapfen-Photorezeptoren) der Makula betroffen, dem zentral gelegenen Bereich des „schärfsten“ Sehens der Netzhaut; deshalb geht bei der AMD insbesondere das zentrale Sichtfeld verloren. Die Zapfen sind bei Tageslicht aktiv und vermitteln zudem unseren Farbeindruck. Im Gegensatz dazu sterben bei einer Retinitis Pigmentosa (RP) zuerst die mehr seitlich gelegenen Sehzellen (Stäbchen-Photorezeptoren) ab, die für das Sehen bei Dämmerung und Nacht zuständig sind. Neben der Nachtblindheit entsteht dabei auch ein sogenannter Tunnelblick, bei dem nur noch Teile des zentralen Sichtfeldes wahrgenommen werden. Im weiteren Verlauf der RP sterben auch die Sehzellen in der Makula ab, und es kommt zu einer vollständigen Erblindung. Derzeit gibt es keine etablierten Therapien für den Ersatz von Sehzellen.
Integration gelungen, erste Wirkung nachgewiesen
Ein weiterer wichtiger Schritt auf dem Weg zu einer erfolgreichen Transplantation ist der chirurgische Eingriff selbst: Die Zellsuspensionen sind so an und unter die noch verbliebene Netzhaut zu platzieren, dass möglichst wenig Zellen verloren gehen und zugleich das noch vorhandene Gewebe unverletzt bleibt. Der Netzhautchirurg Dr. Boris Stanzel aus der ReSight-Projektgruppe hat hierfür unterschiedliche Operationsverfahren getestet und geeignete identifiziert. Am Ende muss aber geprüft werden, ob die transplantierten Netzhautzellen auch wirklich eine Verbindung mit den nachgeschalteten Zellen in der Empfänger-Netzhaut bilden, um letztlich Signale zum Gehirn leiten zu können. Auch dafür hat ein ReSight-Partner, Professor Günther Zeck, ein Verfahren entwickelt. Dabei wird das Auge des Versuchstieres mit den Ersatzzellen verschiedenen Lichtreizen ausgesetzt; gibt es eine Reaktion, war die Transplantation erfolgreich. Und dies geschah immer dann, wenn die implantierten Zellen stabil in das vorhandene Netzhautgewebe eingebaut waren.
„Unsere Ergebnisse legen nahe, dass wir auf dem richtigen Weg sind. Jetzt gilt es, die Mechanismen der Zellintegration noch genauer zu untersuchen und die Methoden weiter zu optimieren“, resümiert ReSight-Projektleiter Ader und nennt beispielhaft den Zeitfaktor. Denn im Projektverlauf habe sich herausgestellt, dass die Transplantation erfolgreicher verläuft, wenn die Ersatzzellen mehr Zeit als bislang angenommen für die Reifung haben – sowohl in der Phase der Umwandlung von einer Stammzelle in eine Sehzelle im Labor als auch später für die stabile Integration in das noch verbliebene Netzhautgewebe.
Originalpublikation:
Gasparini, J., Tessmer, K., Reh, M., et al. (2022). Transplanted human cones incorporate into the retina and function in a murine cone degeneration model; The Journal of Clinical Investigation 2022; 132(12):e154619. DOI: 10.1172/JCI154619
Ansprechpartner:
Prof. Dr. Marius Ader
Zentrum für Regenerative Therapien
Technische Universität Dresden
Fetscherstraße 105
01307 Dresden
Tel.: 0351 458-82203
E-Mail: marius.ader@tu-dresden.de