Wie alle Medizinprodukte haben digitale Anwendungen hohe regulatorische Anforderungen zu erfüllen, bevor sie in die Patientenversorgung gelangen. Das Team im Forschungsverbund fit4translation zeigt, wie dieser Weg der Translation gelingen kann.
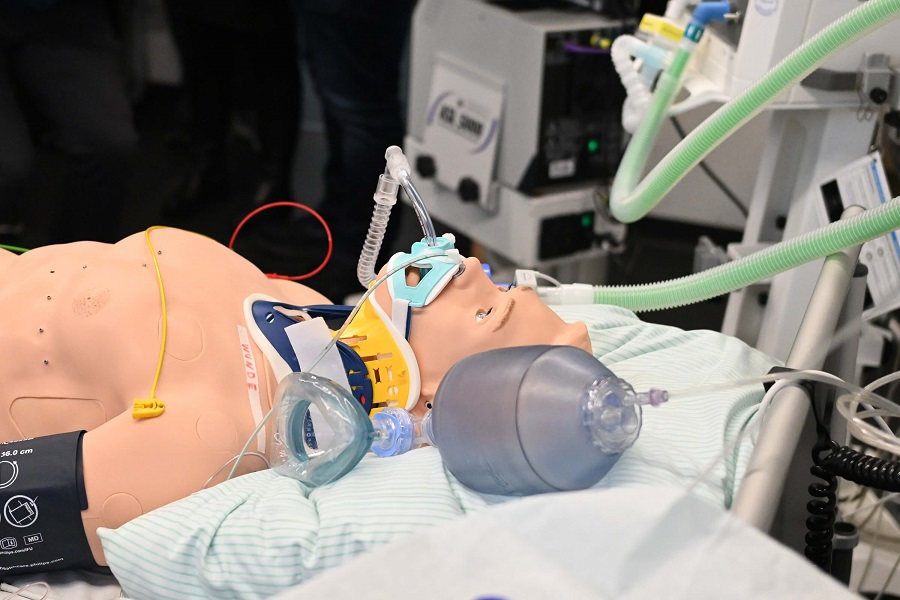
Das Herzstück des Simulationslabors: eine Puppe, an der verschiedene Krankheitsbilder und Zustände simuliert und die entsprechenden physiologischen Parameter gemessen werden können.
Institut für Medizinische Informatik
Für Gesundheits-Apps können die gleichen Regeln gelten wie für die Steuerungssoftware von Herzschrittmachern: Abgestuft nach Risikoklassen fallen sie unter die europäische Medizinprodukteverordnung (Medical Device Regulation, MDR). Das bedeutet: Innovative digitale Anwendungen müssen mit einer sogenannten CE-Kennzeichnung Nutzen und Leistungsfähigkeit, Sicherheit und Zuverlässigkeit nachweisen. Die regulatorischen Hürden dabei sind hoch; viele digitale Assistenzsysteme finden deshalb erst gar nicht den Weg in die klinische Erprobung.
Hilfestellung bei der Translation, dem Übergang in die Patientenversorgung, leistet der vom Bundesministerium für Bildung und Forschung (BMBF) im Rahmen der Medizininformatik-Initiative unterstützte Forschungsverbund fit4translation. In einem Simulationslabor bietet er die Möglichkeit, digitale Anwendungen auf ihre Praxistauglichkeit zu testen und berät darüber hinaus fachlich zur bestmöglichen Translationsstrategie. Im Interview erklärt Dr.-Ing. Myriam Lipprandt, Junior-Professorin an der RWTH Aachen und Projektleiterin von fit4translation, worauf es dabei ankommt.

Junior-Professorin Dr.-Ing. Myriam Lipprandt ist Projektleiterin von fit4translation.
Institut für Medizinische Informatik
Frau Professorin Lipprandt, bei den regulatorischen Anforderungen an Medical Device Software stehen Forschende oft vor großen Hürden – wo genau liegen diese?
Es fehlt an Wissen und Erfahrung und letztlich auch an Infrastruktur in den Universitäten und Forschungseinrichtungen, um Software so zu entwickeln, dass die Entwicklungsprozesse die Anforderungen der europäischen Medizinprodukteverordnung erfüllen. Viele wissen inzwischen, dass ein Entscheidungsunterstützungssystem in der Medizin ein Medizinprodukt ist, wenn es zur Diagnose oder Therapieentscheidung eingesetzt wird. Es fehlt aber an Wissen, welche Anforderungen an ihre tägliche Arbeit daraus entstehen. Möchte man ein solches System in die klinische Prüfung – also die Forschung am oder mit Menschen – oder in die Patientenversorgung einbringen, muss man dies von Anfang an berücksichtigen. Dafür braucht es einen Plan, eine Translationsstrategie.
Wie können Sie bei der Entwicklung einer solchen Strategie helfen?
Wir bauen eine Wissensbasis zu häufig gefragten Themen und ein transparentes Stufenkonzept auf, welche Anforderungen und Aufgaben für welchen Reifegrad der Entwicklung umgesetzt sein müssen. Anhand dieses „Technology Readiness Levels“ (TRL) sollen Wissenschaftlerinnen und Wissenschaftler ihre Projekte selbst einschätzen können und sehen, welche Aufgaben noch vor ihnen liegen. Für die einzelnen Schritte werden entsprechende Checklisten, Lehrmaterialien und Musterdokumente entwickelt und zur Verfügung gestellt. Wir haben bereits erste Schulungskonzepte erarbeitet und bieten auch Tutorials an.
Parallel dazu bieten wir den Datennutzungsprojekten der Medizininformatik-Initiative und anderen öffentlich geförderten Projekten über die mit uns kooperierende TMF (TMF – Technologie- und Methodenplattform für die vernetzte medizinische Forschung e. V.) auch eine individuelle Beratung an. So profitieren die Forschungsprojekte vom Wissen und den Erfahrungen der Forschungscommunity und umgekehrt wir und die TMF von den Projekten.
Wer gab den Anstoß für das von Ihnen aufgebaute Simulationslabor?
Die regulatorischen Anforderungen verlangen, dass die Gebrauchstauglichkeit eines Medizinproduktes mit Anwenderinnen und Anwendern aus der zukünftigen Nutzergruppe unter realen Bedingungen untersucht wird.
In der Medizin gibt es seit etwa 25 Jahren professionelle Simulatortrainings, die Ärztinnen und Ärzte auf kritische Notfallsituationen in der Anästhesie, Intensiv- und Notfallmedizin vorbereiten. Es bietet sich an, diese Simulationskonzepte für Usability-Studien zu nutzen: Wir können die Mensch-Maschine-Interaktion unter realistischen Bedingungen reproduzierbar und ohne Patientengefährdung untersuchen. Mit der Förderung durch das BMBF können wir das Simulations- und Usability-Labor nun so ausbauen, dass es für eine Vielzahl von Szenarien genutzt werden kann.
Wie ist das Labor ausgestattet?
Das Herzstück des Simulationslabors ist ein Patientensimulator – eine Puppe, an der verschiedene Krankheitsbilder und Zustände simuliert und die entsprechenden physiologischen Parameter wie EKG, Blutdruck, Sauerstoffsättigung, aber auch Atemwegswiderstände und die Atemgaszusammensetzung gemessen werden können. Für spezifischere Fragestellungen können wir dies durch weitere Simulatoren unterstützen, z. B. für die Beatmungsmedizin durch einen Lungensimulator. Rund um die Simulatoren können wir die unterschiedlichsten Versorgungssituationen – vom häuslichen Umfeld über den Rettungsdienst bis hin zum OP und der Intensivstation – realitätsnah abbilden.
Wer kann das Simulationslabor nutzen und wie läuft der Zugang praktisch ab?
Digitale Innovationen für den klinischen Alltag
Auf Künstliche Intelligenz (KI) gestützte Systeme und digitale Anwendungen gehören in vielen Kliniken zum medizinischen Alltag und haben immer größeren Anteil an ärztlichen Entscheidungen: „Intelligente“ Software etwa verrät mehr über die Krankheiten zugrunde liegenden Mechanismen und hilft bei der Diagnosestellung. Sie kann krankhafte Veränderungen oft schneller erkennen als das menschliche Auge, frühzeitig vor unerwünschten Wechselwirkungen bestimmter Medikamente warnen und Medizinerinnen und Mediziner bei der Wahl der bestmöglichen Therapie unterstützen. Ein bei Röntgengeräten eingesetztes Bildverarbeitungsprogramm beispielsweise wird rechtlich als Medizinprodukt eingestuft – d. h. es unterliegt den gleichen Gesetzen und Normen, die für Beatmungsgeräte oder Implantate gelten.
Die Dienstleistungen des Labors können über einen Auftrag oder vorzugsweise über eine Forschungskooperation genutzt werden. Wichtig ist, dass es sich um akademische oder vorwettbewerbliche Forschung handelt. Wir befinden uns noch in der Aufbauphase, aber es gibt bereits Pläne für eine erste Nutzung. Voll einsatzbereit wird das Labor Anfang nächsten Jahres sein.
Wann ist der richtige Zeitpunkt, Kontakt mit fit4translation aufzunehmen?
Meist kommen die Projekte erst dann zu uns in die Beratung, wenn sie bereits gefördert werden oder schon laufen. Dann aber kann oft nur noch Schadensminimierung betrieben werden – viele Projekte enden dann im gefürchteten „Tal des Todes“ der Translation und liefern bestenfalls noch Erkenntnisse für künftige Projekte. Dies versuchen wir mit unseren Schulungskonzepten aufzufangen. Aber auch Förderer und Gutachter translationaler Forschungsprojekte könnten die Machbarkeit eines geplanten Projektes anhand des „Technology Readiness Levels“ sowie die notwendige Expertise und Infrastruktur der Antragstellenden stärker prüfen.
Letztlich braucht es ein Konzept zum Aufbau einer Infrastruktur in der Universitätsmedizin, damit diese bei bestimmten, risikoarmen Innovationen die Herstellerverantwortung für Prüfprodukte übernehmen kann – ideal wäre eine Unterstützung ähnlich der der Koordinierungszentren für klinische Studien, die die patientenorientierte Forschung an universitären Standorten unterstützen und beratend begleiten.
Vielen Dank für das Gespräch.
fit4translation
In der Medizininformatik-Initiative (MII), gefördert vom Bundesministerium für Bildung und Forschung (BMBF), arbeiten Wissenschaftlerinnen und Wissenschaftler aus Medizin, Informatik und weiteren Fachrichtungen der deutschen Universitätskliniken zusammen. Im Rahmen der MII wird der Forschungsverbund fit4translation in den Jahren 2023 bis 2027 mit rund zwei Millionen Euro gefördert. Die Leitung des Verbundes liegt bei Junior-Professorin Dr.-Ing. Myriam Lipprandt von der Rheinisch-Westfälischen Technischen Hochschule (RWTH) Aachen. Weitere Teilprojekte werden an dem am Universitätsklinikum Bonn aufgebauten Datenintegrationszentrum sowie am Institut für Medizinische Informatik der Universität Münster durchgeführt. Über die „Technologie- und Methodenplattform für die vernetzte medizinische Forschung“ (TMF) berät das fit4translation-Team andere Forschende, wie Erkenntnisse aus ihren Vorhaben möglichst schnell in eine breite Anwendung gelangen.
Ansprechpartnerin:
Jun.-Prof. Dr.-Ing. Myriam Lipprandt
Institut für Medizinische Informatik
Universitätsklinikum Aachen
Rheinisch-Westfälische Technische Hochschule (RWTH) Aachen
Pauwelsstraße 30
52074 Aachen
Tel.: 0241 80-88795
E-Mail: mlipprandt@ukaachen.de