Indem Sie zulassen, dass wir Ihre Besuche auf dieser Webseite anonymisiert mitzählen, helfen Sie uns das Angebot für Nutzerinnen und Nutzer zu optimieren. Dafür verwenden wir Cookies. Die erfassten Daten werden nicht an Dritte weitergegeben. Mehr Informationen finden Sie in unserer Datenschutzerklärung. Wer unsere Dienstleister sind, können Sie im Impressum unter folgendem Link nachlesen: Impressum.
Frühgeborene, die künstlich beatmet werden, leiden oft an einer sogenannten Bronchopulmonalen Dysplasie. DZL-Forscher suchen nach Ursachen und haben ein Modell entwickelt, mit dem erstmals eine frühe und sichere Diagnose der Erkrankung greifbar scheint.

Dank medizinischer Fortschritte ist in den vergangenen Jahren die Zahl der Babys, die eine Frühgeburt überlebt haben, gestiegen. Die Lunge gehört beim heranwachsenden Fötus jedoch zu den am spätesten entwickelten Organen und ist bei Frühgeburten vor der 35. Schwangerschaftswoche noch nicht vollständig ausgereift. Dadurch sind die Atemwege der kleinen Patienten anfällig für Komplikationen. Die häufigste Lungenerkrankung, von der Frühgeborene betroffen sind, ist die Bronchopulmonale Dyplasie, kurz BPD. Symptome können eine schnelle und angestrengte Atmung, ein bleibender erhöhter Sauerstoffbedarf und vermehrte Infekte sein. Frühgeborenen Säuglingen mangelt es bei Geburt an voll ausgebildeten Lungenbläschen und den entsprechenden Blutgefäßen, die den Sauerstoff aus den Lungenbläschen aufnehmen.
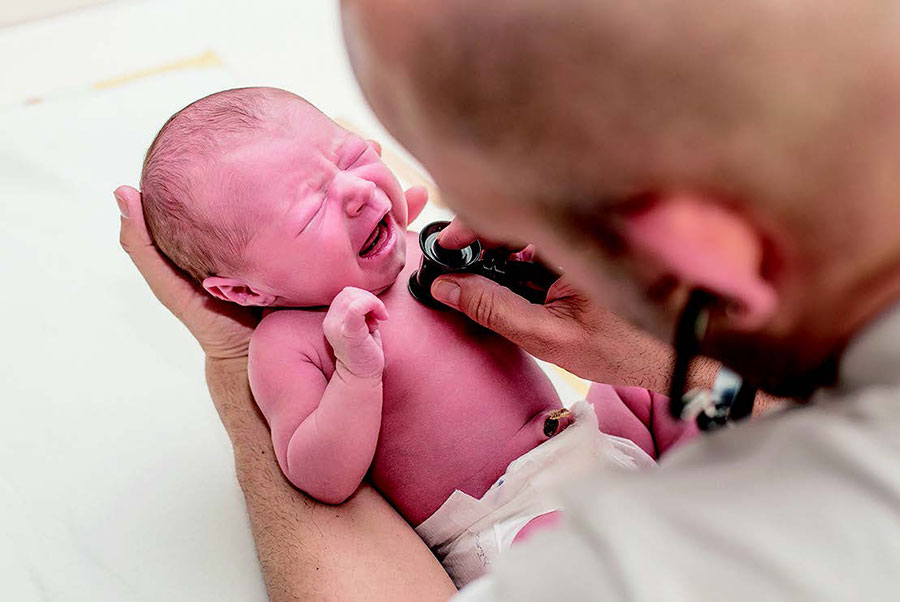
Die bronchopulmonale Dysplasie ist die häufigste Lungenerkrankung von Frühgeborenen. DZL-Forscher haben ein Verfahren erarbeitet, mit dem erstmals eine frühe und sichere Diagnose der Erkrankung möglich erscheint.
S. Kobold/Fotolia
Die Bronchopulmonale Dysplasie (BPD) ist die häufigste Lungenerkrankung, an der Frühgeborene leiden. Circa 15-30 Prozent der Frühgeborenen mit einem Geburtsgewicht von unter 1.000 Gramm oder einer Schwangerschaftsdauer von unter 28 Wochen, aber auch später Geborene sind davon betroffen. Es ist eine chronische, jedoch potentiell reversible Erkrankung. Als Therapieoptionen zur Verfügung stehen unter anderem Kortison, Vitamin A sowie unterstützende Maßnahmen wie die Optimierung der Flüssigkeitszufuhr und der Beatmungssituation. Bei der Mehrheit der kleinen Patientinnen und Patienten mit BPD verbessern sich die Symptome im ersten Lebensjahr deutlich. Allerdings leiden sie häufiger an einer Übererregbarkeit des Bronchialsystems mit vermehrten Entzündungen der Atemwege in den ersten Lebensjahren. Bei Frühgeborenen mit einer schweren Form der BPD ist die körperliche, motorische und geistige Entwicklung oft verzögert. Im Schulalter haben sie – verglichen mit Gleichaltrigen, die voll ausgetragen wurden – mehr Atemwegsprobleme, ein höheres Risiko für allergisches Asthma und häufig eine allgemein verringerte Lungenfunktion.
Meist entwickelt sich die Bronchopulmonale Dysplasie, wenn Frühgeborene künstlich beatmet werden und eine Sauerstofftherapie durchgeführt werden muss, bis die Lunge genug reifen konnte. Obwohl die künstliche Beatmung und die Behandlung mit Sauerstoff oft lebensnotwendig sind, kann dadurch die Lunge des Säuglings geschädigt werden und eine Entzündung entstehen, welche die Lungenerkrankung BPD auslösen kann. Auch vorgeburtliche Faktoren wie der Einfluss von Infektionen oder ein vermindertes Wachstum des Kindes im Mutterleib können zu der Entstehung der BPD beitragen. „Meist trifft die Lungenerkrankung BPD Frühgeborene, aber auch reife Neugeborene können an BPD erkranken“, erklärt die DZL-Forscherin Dr. Anne Hilgendorff vom Institut für Lungenbiologie am Helmholtz Zentrum München. Die Fachärztin für Kinder- und Jugendmedizin befasst sich in ihren Forschungsarbeiten insbesondere mit Erkrankungen von Neugeborenen und mit der Behandlung von Frühgeborenen.
BPD kann eine vorübergehende Erkrankung sein - bei der Mehrheit der kleinen Patientinnen und Patienten mit BPD verbessern sich die Symptome im ersten Lebensjahr deutlich. Bei einigen Kindern können die Symptome aber bis ins Erwachsenenalter reichen, wodurch das Risiko für Atemwegsprobleme und für Lungenerkrankungen wie die Chronisch Obstruktive Lungenerkrankung (COPD) steigen kann.
Welche Ursachen genau bei einer BPD von Bedeutung sind, ist bislang allerdings kaum geklärt. Neben Beeinträchtigungen durch die künstliche Beatmung selbst und eine potentiell schädigende Wirkung durch eine zu hohe Sauerstoffkonzentration gelten charakteristische Entzündungsprozesse und die funktionelle sowie strukturelle Unreife der Lunge als weitere Auslöser.
In einer Studie, die auch eine genetische Analyse in insgesamt 1.061 Neugeborenen, darunter 492 mit der Diagnose „Bronchopulmonale Dysplasie“, umfasst hat, haben DZL-Forscher und Wissenschaftler weiterer Institutionen nun jedoch einen molekularen Mechanismus entdeckt, der entscheidend zur Krankheitsentwicklung beiträgt. Sie fanden heraus, dass bestimmte genetische Veränderungen, konkret im Gen für den Wachstumsfaktor-Rezeptor PDGFR-α (Platelet-Derived Growth Factor Receptor α), das Risiko für die Erkrankung signifikant erhöhen. Zellen des Lungengewebes, die PDGFR-α produzieren, tragen zur Bildung der Lungenbläschen und der Entwicklung des Lungengerüstes bei. Auch in isolierten Zellen aus den Lungen betroffener Kinder konnten die Forscherinnen und Forscher die genetischen Auffälligkeiten bestätigen.
„In einem weltweit nur an wenigen Standorten etablierten Versuchsmodell konnten wir erstmals zeigen, dass eine geringere Produktion von PDGFR-α in Verbindung mit künstlicher Beatmung zu den typischen Symptomen einer BPD führte“, erklärt Studienleiterin Hilgendorff. Die Krankheitssymptome konnten die Wissenschaftler im Versuchsmodell allerdings vermindern, wenn sie die Signalweitergabe über PDGFR-α künstlich erhöhten. In weiteren Versuchen konnten sie zudem zeigen, dass der Entzündungsbotenstoff TGF-β (Transforming Growth Factor β) zur Entwicklung der BPD beiträgt: Er drosselt ebenfalls die Produktion von PDGFR-α. Durch die mechanische Verletzung der Lunge im Rahmen der künstlichen Beatmung wird das Signalmolekül TGF-β vermutlich besonders oft ausgeschüttet. Das könne sowohl genetisch bedingt als auch durch Entzündungen vermittelt sein oder verschlimmert werden, so die Wissenschaftler. In weiteren Studien wollen sie noch intensiver überprüfen, ob es möglich ist, gezielt therapeutisch in diese Signalkette einzugreifen und so einen Weg für mögliche Therapien zu eröffnen.
Bisher können Ärzte die BPD häufig jedoch auch nicht sicher und nicht rechtzeitig genug erkennen, um bereits nach der Geburt wichtigen Therapien einzuleiten. Ein Forschungsteam um Hilgendorff und Dr. Kai Martin Förster vom Perinatalzentrum am Klinikum der Universität München hat kürzlich ein Verfahren erarbeitet, mit dem erstmals eine frühe und sichere Diagnose der Lungenerkrankung möglich erscheint. Dazu haben die Wissenschaftler Blutplasmaproben von 35 Frühgeborenen analysiert, die in der ersten Lebenswoche gewonnenen wurden. In den Proben suchten sie nach Veränderungen aller erkennbaren Proteine und wiederholten die Untersuchung am 28. Lebenstag der Säuglinge.
Zur Analyse der Daten entwickelten die Wissenschaftler ein statistisches Model, mit dem sich bestimmen lässt, welche Eiweiße bereits direkt nach der Geburt im Blut auf eine drohende BPD hinweisen. Drei Proteine, die bereits im Verdacht stehen, zur Krankheitsentstehung beizutragen, sind in der Analyse auffällig geworden. Sie gehören zu den wichtigsten Krankheitsprozessen, die den Umbau des Lungengerüstes, den Stand der Gefäßentwicklung und die Entzündungsreaktion anzeigen. In Zusammenarbeit mit der Neonatologie der Kinderklinik in Gießen, Privatdozent Dr. Harald Ehrhardt, konnten die Eiweiße in einer zweiten Gruppe Frühgeborener bestätigt und mit Hilfe einer Zusammenarbeit mit der Erasmus Universität in Rotterdam im Lungengewebe Frühgeborener nachgewiesen werden.
Die Forschenden wollen die Ergebnisse jetzt in weiteren Studien überprüfen. „Sollten sich die Ergebnisse erhärten, könnte ein simpler Test entwickelt werden, der ausschließlich die drei Marker-Proteine analysiert und nicht, wie im aufwändigen Prozedere, alle 1.129 Eiweiße. Falls das Verfahren alle Hürden nähme, würde die Frühdiagnose die Therapie der kleinen Patienten erheblich erleichtern und den Erfolg möglicher Behandlung begünstigen“, berichtet Hilgendorff zuversichtlich.
Das im Jahr 2011 gegründete Deutsche Zentrum für Lungenforschung (DZL) ist eines der sechs Deutschen Zentren der Gesundheitsforschung, die vom Bundesministerium für Bildung und Forschung und den Ländern gefördert werden. Im DZL arbeiten exzellente Wissenschaftlerinnen und Wissenschaftler und deren Teams aus universitären und außeruniversitären Institutionen an fünf Standorten auf dem Gebiet der Lungenforschung zusammen. Gemeinsam haben sie das Ziel, neue Ansätze für die Prävention, Diagnose und Therapie von Lungenerkrankungen zu entwickeln. Acht Krankheitsbereiche stehen im Fokus: Asthma und Allergien, Chronisch Obstruktive Lungenerkrankung (COPD), Mukoviszidose, Lungenentzündung und Akutes Lungenversagen, Diffus-Parenchymatöse Lungenerkrankungen, Lungenhochdruck und Lungenerkrankungen im Endstadium.
Ansprechpartnerin:
PD Dr. Anne Hilgendorff
Helmholtz Zentrum München - Deutsches Forschungszentrum für Gesundheit und Umwelt (GmbH) Institut für Lungenbiologie & Comprehensive Pneumology Center
Max-Lebsche-Platz 31
81377 München
anne.hilgendorff@helmholtz-muenchen.de
Pressekontakt:
Sabine Baumgarten
Presse- und Öffentlichkeitsarbeit
Deutsches Zentrum für Lungenforschung (DZL)
Aulweg 130
35392 Gießen
s.baumgarten@dzl.de