Patientinnen und Patienten mit einem Glioblastom haben meist eine geringe Lebenserwartung. Oft kehrt der Tumor kurz nach der Operation zurück. Ein internationales Forschungsteam will die Nachsorge optimieren und nimmt dabei den Tumorrand in den Blick.
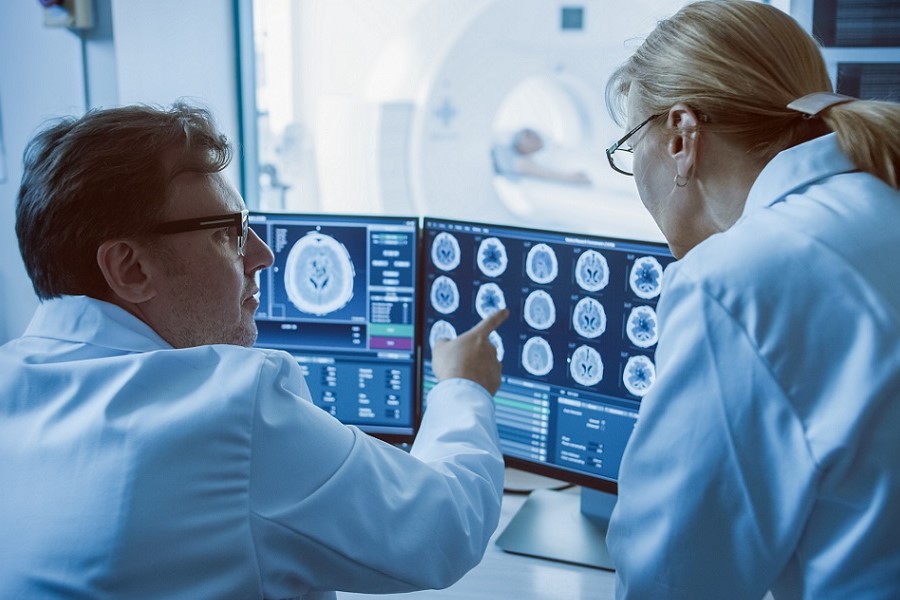
Glioblastome treten in allen Hirnregionen auf. Das macht Operationen oftmals schwierig, weil wichtige Funktionen des Gehirns durch den Eingriff beeinträchtigt werden könnten.
Gorodenkoff/Adobe Stock
Das Glioblastom ist die häufigste Form eines bösartigen Gehirntumors. In Deutschland erkranken jedes Jahr etwa 4.800 Menschen daran. Oft wächst der Tumor über einen längeren Zeitraum hinweg unbemerkt; wenn erste Symptome wie Sehstörungen oder epileptische Anfälle auftreten, kann das Glioblastom schon einen Durchmesser von mehreren Zentimetern erreicht haben. Nach der Diagnose wird der Gehirntumor zunächst operativ entfernt – sofern seine Lage dies erlaubt. Dann folgen Strahlen- und Chemotherapien. Doch trotz dieser intensiven Erstbehandlung liegt die Lebenserwartung vieler Betroffener bei weniger als zwei Jahren. In vielen Fällen kehrt der Tumor sogar bereits innerhalb des ersten Jahres nach der Operation zurück. Ein internationales Forschungsteam mit Partnerinstitutionen aus Deutschland, Luxemburg, Frankreich und Italien entwickelt ein Computermodell, das das individuelle Rückfallrisiko jedes einzelnen Erkrankten vorhersagen soll, um schneller gegensteuern zu können. Das Bundesministerium für Bildung und Forschung (BMBF) unterstützt das Projekt im Rahmen der europäischen Fördermaßnahme ERACoSysMed.
Es gibt gleich mehrere Gründe, warum die Behandlung von Glioblastomen so schwierig ist. Chemotherapeutika schlagen häufig nicht bei allen Zellen des Tumors gleich gut an, weil diese sehr variabel und damit teilweise sehr widerstandsfähig sind. Die Folge: Durch die Behandlung werden nicht immer alle Areale des Gehirntumors erreicht. Ähnlich ist dies bei der Wirkung der Strahlentherapie, auf die die Tumorzellen ebenfalls unterschiedlich reagieren können. Hinzu kommt, dass sich im Randbereich von Glioblastomen einzelne Zellen auch im umliegenden, noch gesunden Gewebe ausbreiten. Wenn Glioblastome in Hirnregionen liegen, die für die Hirnfunktion besonders wichtig sind, können diese Ausläufer des Tumors bei einer Operation nicht vollständig entfernt werden.
Zellen am Tumorrand entscheidend für Krankheitsverlauf
Generell können Chirurginnen und Chirurgen einen Gehirntumor nicht wie an anderen Stellen des Körpers mit einem großzügigen Sicherheitsabstand entfernen. Denn neben der Entfernung des Tumors gilt es, eine Schädigung des Gehirns zu vermeiden. „Trotz optimierter Operationsverfahren bleibt fast unausweichlich ein kleiner Rand zurück, der vom Tumor als Ausgangspunkt in das übrige Gewebe genutzt werden könnte“, erklärt Projektkoordinator Dr. Peter Raab von der Medizinischen Hochschule Hannover. Der Neuroradiologe und seine Kolleginnen und Kollegen des internationalen Forschungsteams interessieren sich daher vor allem für das Verhalten der Glioblastom-Zellen am Tumorrand. „Denn das kann entscheidend sein für das weitere Verhalten des Tumors“, so Raab. „Je präziser wir hierfür eine Prognose stellen können, desto genauer kann die Nachsorge angepasst und die Therapieplanung optimiert werden.“
Systemmedizin
Ob Herz-Kreislauf-Erkrankungen, Demenz oder Krebs – viele Krankheiten haben eines gemeinsam: Entstehung, Verlauf und Therapieerfolg hängen von zahlreichen Faktoren ab. Dazu gehören die genetische Veranlagung, der persönliche Lebensstil und die äußeren Einflüsse. Das Wissen über die Rolle dieser Faktoren wächst dank der modernen Forschung rasant an. Aufgabe der Systemmedizin ist es, das Zusammenspiel all dieser Faktoren umfassend und mithilfe von mathematischen Modellen zu entschlüsseln – und so den Weg für neue Therapien und Präventionsstrategien zu ebnen. Dafür verzahnt sie neueste Erkenntnisse aus der lebenswissenschaftlichen Grundlagenforschung und der Medizin mit dem Wissen und den Methoden aus Informatik, Mathematik und Physik.
Um das Verhalten der Tumorzellen möglichst treffsicher vorhersagen zu können, haben die Forschenden mithilfe neuer computerbasierter Methoden unterschiedliche Daten von Patientinnen und Patienten analysiert und ausgewertet. Mit diesen großen Datenmengen, unter anderem aus Schnittbilduntersuchungen des Tumors und Informationen aus den histologischen Untersuchungen des Gewebes vom Tumorrand, haben die Wissenschaftlerinnen und Wissenschaftler ein Computermodell „gefüttert“ und trainiert. Hierbei kam ihnen die interdisziplinäre Zusammenarbeit zwischen den einzelnen biomedizinischen Fachdisziplinen auf der einen sowie mit Expertinnen und Experten aus Mathematik sowie Bioinformatik auf der anderen Seite zugute.
Zeitpunkt der Therapie optimieren
Besteht die Gefahr, dass der Tumor an derselben Stelle wieder nachwächst? Hat sich das Glioblastom bereits im umliegenden Gewebe ausgebreitet? Künftig soll das datenbasierte Modell diese und weitere zentrale Fragen zu jeder und jedem einzelnen Erkrankten im Rahmen der Nachsorge beantworten und so individuelle Risikoeinschätzungen für den weiteren Verlauf der Krankheit ermöglichen. „Dieses neu gewonnene Wissen wird wesentlich dazu beitragen, künftige Therapieentscheidungen zu verbessern und den Zeitpunkt für Nachsorgeuntersuchungen, weitere Operationen sowie den Einsatz von Strahlen- und Chemotherapien zu optimieren“, sagt Raab. In den beteiligten medizinischen Zentren in Hannover und Luxemburg könnte das Analysetool bald schon zum Einsatz kommen. In einigen Jahren, so hoffen die Forschenden, könnte der neue Ansatz dann auch weit verbreitet in der klinischen Praxis genutzt werden. Bis dahin wollen sie das Modell auf Basis weiterer Datensätze stetig verbessern.
Doch schon jetzt eröffnen sich weitere Perspektiven. Im Rahmen des Projekts hat das Forschungsteam auch die Interaktion der Tumorzellen mit den Abwehrzellen im Gehirn untersucht. „Wir haben Hinweise gefunden, dass bestimmte Immunzellen des Gehirns das Wachstum des Tumors teilweise begünstigen können“, erklärt Professor Dr. Friedrich Feuerhake vom Institut für Neuropathologie an der Medizinischen Hochschule Hannover. „Wenn sich diese Vermutungen erhärten, können sich völlig neue Ansätze für die Behandlung von Glioblastomen ergeben. Denkbar wäre zum Beispiel der Einsatz neuartiger Medikamente, die zielgerichtet das Immunsystem beeinflussen, um so indirekt die Ausbreitung und das Wachstum des Tumors auszubremsen.“
Ansprechpartner:
Dr. Peter Raab
Medizinische Hochschule Hannover
Carl-Neuberg-Straße 1
30625 Hannover
Tel.: 0511 532-6654
E-Mail: raab.peter@mh-hannover.de
Prof. Dr. Friedrich Feuerhake
Medizinische Hochschule Hannover
Carl-Neuberg-Straße 1
30625 Hannover
Tel.: 0511 532-4500
E-Mail: Feuerhake.Friedrich@mh-hannover.de