Indem Sie zulassen, dass wir Ihre Besuche auf dieser Webseite anonymisiert mitzählen, helfen Sie uns das Angebot für Nutzerinnen und Nutzer zu optimieren. Dafür verwenden wir Cookies. Die erfassten Daten werden nicht an Dritte weitergegeben. Mehr Informationen finden Sie in unserer Datenschutzerklärung. Wer unsere Dienstleister sind, können Sie im Impressum unter folgendem Link nachlesen: Impressum.
Jüngste Forschungsergebnisse zeigen, dass Entzündungsmechanismen die Entwicklung einer Alzheimer-Erkrankung vorantreiben.

In Deutschland leben Schätzungen zufolge rund 1,6 Millionen Menschen mit Demenz. Viele von ihnen sind von der Alzheimer-Krankheit betroffen – eine Hirnerkrankung, die Nervenzellen allmählich zugrunde gehen lässt. Bislang gibt es keine wirksame Behandlung. Auch sind die Mechanismen, die diese Erkrankung vorantreiben und Zellen des Gehirns letztlich absterben lassen, nicht gänzlich verstanden. Aktuelle Forschungsergebnisse des Deutschen Zentrums für Neurodegenerative Erkrankungen (DZNE) und der Universität Bonn geben nun neue Einblicke in den Krankheitsprozess.
Es ist typisch für die Alzheimer-Erkrankung, dass winzige Eiweißstoffe verkleben und sich im Gehirn ablagern. Diese Amyloid-Beta-Peptide – kurz „Abeta-Peptide“ genannt – stehen daher im Verdacht, Nervenzellen zu schädigen. In jüngsten Jahren hat sich zudem herausgestellt, dass das Immunsystem des Gehirns auf diese Eiweißstoffe reagiert. „Die Abeta-Peptide ähneln Molekülen, die auf der Oberfläche mancher Bakterien vorkommen. Die Immunabwehr geht daher fälschlicherweise von einer Infektion aus und versucht, die Eiweißstoffe zu beseitigen. Das ist zunächst eine positive Reaktion. Doch weil die Abeta-Peptide infolge der Alzheimer-Erkrankung ständig nachproduziert werden, entwickelt sich letztlich eine chronische Entzündung“, erläutert Professor Michael Heneka, Arbeitsgruppenleiter am DZNE und Direktor an der Klinik für Neurodegenerative Erkrankungen und Gerontopsychiatrie der Universität Bonn.
„Alzheimer ist eine schleichende Erkrankung. Die Ablagerung und Ausbreitung der Abeta-Peptide beginnt vermutlich Jahrzehnte, bevor Störungen des Kurzeitgedächtnisses oder andere klinische Symptome auftreten“, so Heneka weiter. „Ein besseres Verständnis dieser Prozesse könnte daher ein Schlüssel zu neuartigen Therapien sein. Hier ginge es darum, Alzheimer im Frühstadium zu behandeln. Also noch bevor sich ein Abbau der geistigen Fähigkeiten bemerkbar macht.“
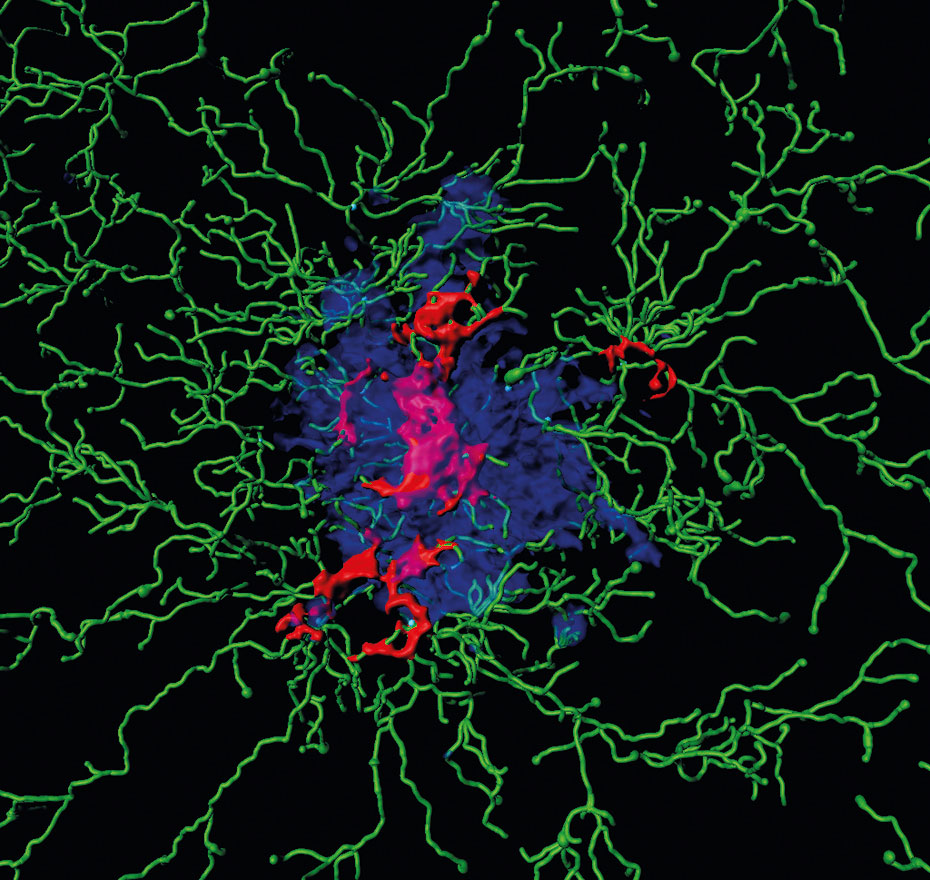
Ablagerungen im Gehirn: Dargestellt sind Entzündungsproteine (sogenannte ASC Specks, rot) im Kern einer Ansammlung von Amyloid-Beta-Peptiden (blau) sowie Immunzellen (grün).
Computervisualisierung auf der Grundlage mikroskopischer Bilddaten von Dario Tejera, Universität Bonn
Im Rahmen des Exzellenzclusters „ImmunoSensation“ der Universität Bonn befassen sich Heneka und weitere Fachleute schon länger mit der Frage, wie Immunreaktionen des Gehirns die Entwicklung der Alzheimer-Erkrankung beeinflussen. In früheren Studien hatten sie herausgefunden, dass ein molekularer Sensor des Immunsystems – ein Proteinkomplex mit der Bezeichnung „NLRP3-Inflammasom“ – eine Schlüsselrolle spielt. Der Proteinkomplex ist eine Art Brandmelder, der im Gehirn von Alzheimer-Patienten – so zeigte sich – aktiviert ist. Auch bei Mäusen mit Symptomen ähnlich denen von Alzheimer-Patienten konnten die Forscherinnen und Forscher nachweisen, dass das Inflammasom am Krankheitsgeschehen beteiligt ist.
Tatsächlich wird mit der Aktivierung dieses Proteinkomplexes eine Reaktionskette in Gang gesetzt: Das Inflammasom verändert seine Struktur und verbindet sich mit einem weiteren an Immunreaktionen beteiligtem Molekül: dem Protein ASC. Die dabei entstehenden Aggregate werden „ASC Specks“ genannt. Zudem wird das Immunsystem veranlasst, entzündungsfördernde Substanzen herzustellen.
Über neueste Erkenntnisse rund um diese Vorgänge haben Heneka und Kollegen jüngst in der renommierten Fachzeitschrift „Nature“ berichtet. An der Studie war neben weiteren Fachleuten aus Europa und den USA auch eine Arbeitsgruppe um Professor Eicke Latz, Leiter des Instituts für Angeborene Immunität der Universität Bonn, beteiligt.
Die aktuellen Untersuchungen zeigen, dass die ASC Specks von aktivierten Immunzellen des Gehirns – den „Mikroglia“ – freigesetzt werden. Darüber hinaus belegen die Studienergebnisse, dass zwischen den Mechanismen des Immunsystems und der Krankheitsentwicklung eine Verbindung besteht. „Wir haben festgestellt, dass sich die ASC Specks mit den Abeta-Peptiden verbinden und dass sie deren Ablagerung fördern. Damit tragen die ASC Specks direkt zum Fortschreiten der Pathologie und zur Krankheitsentwicklung bei“, sagt Heneka.
Diese Einschätzung stützt sich auf eine Reihe von Labor-Studien mit Mäusen, beziehungsweise sogenannten Mausmodellen der Alzheimer-Erkrankung und auf die Analyse von Hirngewebe verstorbener Patienten.
„Zusammenfassend legen unsere Ergebnisse nahe, dass Entzündungen des Gehirns nicht nur eine Begleiterscheinung der Alzheimer-Krankheit sind. Sie tragen vielmehr dazu bei, dass die Erkrankung voranschreitet. Die ASC Specks spielen als Entzündungsproteine dabei eine wichtige Rolle“, sagt Heneka. „Eine Beeinflussung der Immunantwort könnte daher neue Möglichkeiten für die Behandlung von Alzheimer auftun. Deshalb wollen wir einerseits diese Vorgänge noch besser verstehen. Anderseits arbeiten wir an Wirkstoffen, um die Entzündungsmechanismen günstig zu beeinflussen.“
„Microglia-derived ASC specks cross-seed amyloid-β in Alzheimer’s disease“, Carmen Venegas, Sathish Kumar et al., Nature (2017), DOI: 10.1038/nature25158 „NLRP3 is activated in Alzheimer’s disease and contributes to pathology in APP/PS1 mice”, Michael Heneka et al., Nature (2013), DOI: 10.1038/nature11729
Das Deutsche Zentrum für Neurodegenerative Erkrankungen e. V. (DZNE) erforscht die Ursachen von Störungen des Nervensystems und entwickelt Strategien zur Prävention, Therapie und Pflege. Es bündelt exzellente, über Deutschland verteilte Expertise innerhalb einer einzigen Forschungseinrichtung und umfasst die Standorte Berlin, Bonn, Dresden, Göttingen, Magdeburg, München, Rostock/Greifswald, Tübingen, Ulm und Witten.
Das DZNE kooperiert eng mit Universitäten, deren Kliniken und außeruniversitären Einrichtungen. Es ist Mitglied der Helmholtz-Gemeinschaft Deutscher Forschungszentren und gleichzeitig eines von sechs Deutschen Zentren der Gesundheitsforschung, die vom Bundesministerium für Bildung und Forschung (BMBF) zur Bekämpfung der wichtigsten Volkskrankheiten eingerichtet wurden. Das Zentrum wird vom BMBF und Bundesländern gefördert, in denen die Standorte des DZNE angesiedelt sind.
Mehr Informationen: www.dzne.de und www.dzne.de/facebook
Ansprechpartner:
Prof. Dr. Michael Heneka
Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE)
c/o Universität Bonn
Klinik für Neurodegenerative Erkrankungen und Gerontopsychiatrie
Sigmund-Freud-Straße 25
53127 Bonn
michael.heneka@dzne.de
Pressekontakt:
Dr. Marcus Neitzert
Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE)
Stabsstelle Kommunikation
Sigmund-Freud-Straße 27
53127 Bonn
marcus.neitzert@dzne.de