Indem Sie zulassen, dass wir Ihre Besuche auf dieser Webseite anonymisiert mitzählen, helfen Sie uns das Angebot für Nutzerinnen und Nutzer zu optimieren. Dafür verwenden wir Cookies. Die erfassten Daten werden nicht an Dritte weitergegeben. Mehr Informationen finden Sie in unserer Datenschutzerklärung. Wer unsere Dienstleister sind, können Sie im Impressum unter folgendem Link nachlesen: Impressum.
Antibiotikaresistenzen gehören zu den größten globalen Bedrohungen für die öffentliche Gesundheit. DZIF-Forschende in Bonn untersuchten, wie sich der Konkurrenzkampf unterschiedlicher Bakterien für die Entwicklung neuer Antibiotika nutzen lässt.

Immer mehr bakterielle Krankheitserreger werden resistent gegen die derzeit zur Verfügung stehenden Antibiotika. Das ist ein zunehmend ernstes globales Problem und die Entwicklung neuer Antibiotika daher dringend erforderlich. Dafür infrage kommende antibakterielle Wirkstoffe stammen vielfach von Bakterien, die diese Substanzen nutzen, um sich in ihrer natürlichen Umgebung und im Wettbewerb mit bakteriellen Konkurrenten Vorteile zu verschaffen. Auf der Suche nach neuartigen antimikrobiellen Substanzen nehmen Wissenschaftlerinnen und Wissenschaftler daher auch bereits bekannte Bakteriengruppen genauer unter die Lupe.
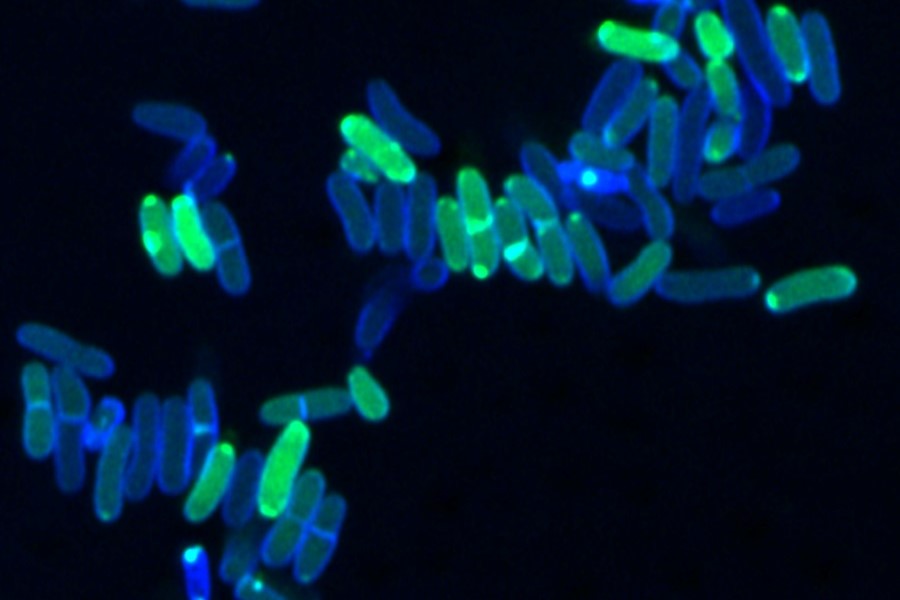
Anreicherung des grün markierten antibiotischen Wirkstoffs Epilancin A37 in blau gefärbten Corynebakterien.
UKB/Jan-Samuel Puls
In Staphylokokken – einer Gattung grampositiver Bakterien, die zum normalen Mikrobiom von Haut und Schleimhäuten gehört – wurden Forschende des Deutschen Zentrums für Infektionsforschung (DZIF) an der Universität und am Universitätsklinikum Bonn nun fündig. Sie entdeckten die neuartige Substanz Epilancin A37, die sich gezielt gegen Corynebakterien einsetzen lässt, die Hauptkonkurrenten der Staphylokokken. Unter der Leitung von Dr. Fabian Grein und Professorin Dr. Tanja Schneider arbeiteten die Wissenschaftlerinnen und Wissenschaftler dabei eng mit einem Team um Professor Dr. Ulrich Kubitscheck am Clausius-Institut für Physikalische und Theoretische Chemie der Universität Bonn zusammen.
Antibakterielle Substanzen werden meist von Pilzen oder Bakterien in der natürlichen Umwelt produziert. Dazu gehören vor allem Böden und marine Ökosysteme, aber auch die natürliche Mikrobiota im menschlichen Körper, die aus Mikroorganismen wie Bakterien, Viren und Pilzen besteht. Dies macht die natürliche Umwelt zu einer ergiebigen Quelle für die Entdeckung neuer Antibiotika mit potenziellem therapeutischem Nutzen.
Mikroorganismen produzieren antimikrobielle Wirkstoffe als Abwehrmechanismus, um sich in ihrer Umgebung gegenüber anderen Mikroorganismen durchzusetzen. Diese Stoffe hemmen das Wachstum konkurrierender Mikroben und helfen ihren Produzenten, sich Nährstoffe und Raum zu sichern.
Lantibiotika sind antimikrobielle Peptide, organische Verbindungen also, die aus einer Verknüpfung mehrerer Aminosäuren hervorgegangen sind. Sie werden von grampositiven Bakterien gebildet und haben oft ein sehr enges Wirkungsspektrum. „Solche Verbindungen sind aus medizinischer Sicht jedoch hochinteressant, da sie ganz spezifisch einzelne Organismengruppen angreifen könnten, ohne die gesamte Bakterienflora zu beeinträchtigen, wie dies zum Beispiel bei Breitbandantibiotika der Fall ist“, sagt DZIF-Wissenschaftler Dr. Fabian Grein, Mitglied im Transdisziplinären Forschungsbereich „Life & Health“ an der Universität Bonn.
Über diese antimikrobiellen Peptide ist bisher nur wenig bekannt. „Wir konnten zeigen, dass Epilancine bei Staphylokokken weit verbreitet sind, was ihre ökologische Bedeutung unterstreicht“, sagt Jan-Samuel Puls, Erstautor der im ISME Journal veröffentlichten Studie und Doktorand am Institut für Pharmazeutische Mikrobiologie des Universitätsklinikums Bonn (UKB). Denn Staphylokokken und Corynebakterien sind wichtige Gattungen der menschlichen Mikrobiota – der Gesamtheit aller Mikroorganismen wie Bakterien, Viren und Pilze –, die die Haut und Schleimhäute, zum Beispiel in der Nase, besiedeln und eng mit Gesundheit und Krankheit verbunden sind. Die Notwendigkeit, ein solches Peptid zu produzieren, deutet auf einen ausgeprägten Wettbewerb zwischen den Bakterienarten hin. Die Forschenden konnten zeigen, dass das neu entdeckte Epilancin A37 sehr spezifisch gegen Corynebakterien wirkt, die zu den Hauptkonkurrenten der Staphylokokken im Hautmikrobiom gehören.

Professor Ulrich Kubitscheck, Jan-Samuel Puls, Dominik Brajtenbach und Dr. Fabian Grein (v.l.n.r.) haben ein neues Lantibiotikum mit einzigartigem Wirkmechanismus entdeckt.
UKB/Rolf Müller
„Diese Spezifität wird vermutlich über einen ganz speziellen Wirkmechanismus vermittelt, den wir im Detail entschlüsseln konnten“, sagt Grein, der bis vor kurzem Leiter der DZIF-Forschungsgruppe „Bakterielle Interferenz“ am UKB war. Das Epilancin A37 dringt in die Corynebakterienzelle ein, zunächst ohne diese zu zerstören. Die antimikrobiellen Peptide reichern sich in der Zelle an und lösen dann die Zellmembran von innen auf, wodurch das Corynebakterium abgetötet wird.
Dr. Thomas Fließwasser, DZIF-Wissenschaftler am Institut für Pharmazeutische Mikrobiologie des UKB und kommissarischer Leiter der DZIF-Forschungsgruppe „Bakterielle Interferenz“, ergänzt: „Unsere Studie zeigt, wie durch einen spezifischen Wirkmechanismus eine einzelne Bakteriengattung gezielt bekämpft werden kann. Sie dient uns damit als eine Art Machbarkeitsnachweis – und birgt zugleich die Hoffnung, dass die neuartige Substanz und ihr Wirkmechanismus als Grundlage für die Entwicklung neuer Antibiotika dienen kann.“
Im Deutschen Zentrum für Infektionsforschung (DZIF) entwickeln bundesweit mehr als 650 Wissenschaftlerinnen und Wissenschaftler aus 35 Institutionen gemeinsam neue Ansätze zur Vorbeugung, Diagnose und Behandlung von Infektionskrankheiten. Das DZIF ist eines der Deutschen Zentren der Gesundheitsforschung (DZG), die vom Bundesministerium für Bildung und Forschung (BMBF) und den Sitzländern zur Bekämpfung der wichtigsten Volkskrankheiten gegründet wurden.
Weitere Informationen: www.dzif.de.
Originalpublikation:
Puls, J.-S., Winnerling, B., Power, J. J. et al. (2024). Staphylococcus epidermidis bacteriocin A37 kills natural competitors with a unique mechanism of action. The ISME Journal 2024. DOI: 10.1093/ismejo/wrae044
Wissenschaftlicher Ansprechpartner:
Dr. Fabian Grein
Institut für Pharmazeutische Mikrobiologie
Rheinische Friedrich-Wilhelms-Universität Bonn
Meckenheimer Allee 168
53115 Bonn
grein@uni-bonn.de
Pressekontakt:
Dr. Nicola Wittekindt
Presse- und Öffentlichkeitsarbeit
Geschäftsstelle des DZIF e. V.
Inhoffenstraße 7
38124 Braunschweig
Telefon: 0531 6181-1170-54
presse@dzif.de