Die Nationale Dekade gegen Krebs will große ungelöste Fragen der Krebsmedizin erforschen. Dazu gehört die Entwicklung von Therapieresistenzen. Eine BMBF-Richtlinie fördert nun die Erforschung der dahinterstehenden Mechanismen im Rahmen der Dekade.
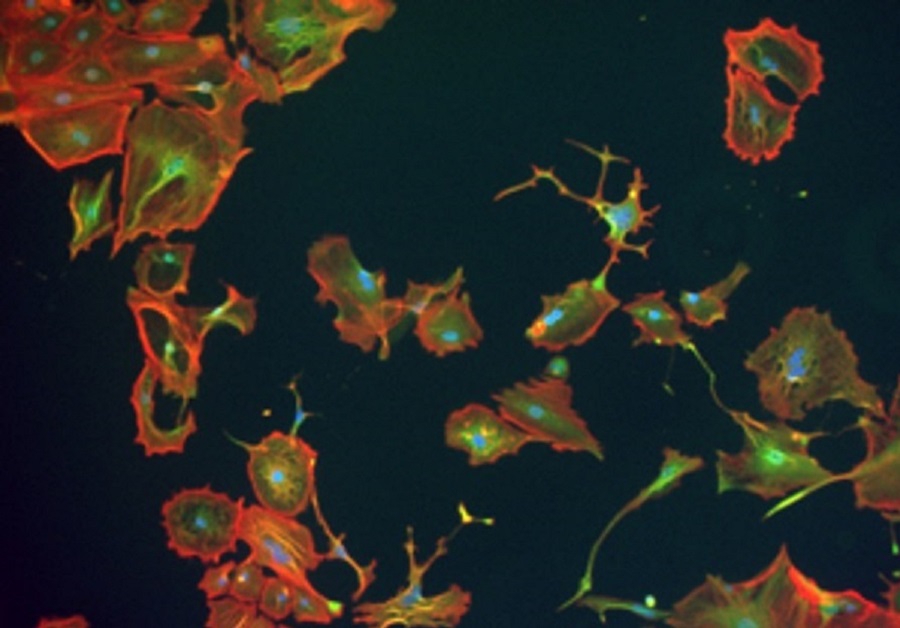
Auch im Labor kultivierte Zellen einer Sarkomkrebszelllinie wachsen unterschiedlich aus. Die Forschenden können Zellbestandteile (Zellkern: blau, grün: ein Stoffwechselenzym, rot: ein Strukturprotein) anfärben und damit sichtbar machen.
Samuel Charles Umbaugh - Labor Prof Froehling
Bei der Ausbildung von Therapieresistenzen spielt die Dynamik des Krebsgeschehens eine große Rolle. In einem Tumor gibt es verschiedene auf krankhafte Weise veränderte Zellen, die unterschiedliche Wege nutzen, um sich zu vermehren. Das bezeichnet man als Tumorheterogenität. Die Varianz der Zellen kann durch bestimmte Einflüsse (u.a. durch die Therapie selbst) weiter zunehmen.
Je verschiedener die Zellen wachsen, desto eher gelingt es einigen mit „raffinierteren“ Strategien, die Behandlung zu überleben. Sie vermehren sich wieder und nehmen den Raum derer ein, die durch die Therapie eliminiert wurden. So besteht der Tumor am Ende überwiegend aus Krebszellen, die nicht mehr auf Medikamente reagieren.
Mehr Verständnis hilft, Angriffspunkte zu finden
Moderne Krebsmedikamente greifen Krebszellen gezielt an ihren innerzellulären Vorgängen an. Doch noch fehlt das tiefergehende Wissen, um der Tumorheterogenität therapeutisch zu begegnen: Die grundlegenden Mechanismen beim Voranschreiten der Tumorheterogenität und damit der Resistenzbildung bei Krebs sind nur grob entschlüsselt.
Die Förderung von Verbundforschung zum Themenkomplex „Tumorheterogenität, klonale Tumor-Evolution und Therapieresistenz“ des Bundesministeriums für Bildung und Forschung (BMBF) soll den Erkenntnisgewinn hierbei beschleunigen.
Ausgewählte Verbundprojekte
Ein internationales wissenschaftliches Gutachtergremium unter Einbindung von Patientenvertretungen hat nun zwei Verbünde zur Förderung empfohlen, die den Forschungsbedarf adressieren:
1. Das Konsortium HEROES-AYA
“Heterogenität, Evolution und Resistenz von durch onkogene Fusionsgene getriebenen Sarkomen bei Jugendlichen und jungen Erwachsenen”
Die Forschenden dieses Verbundes widmen sich der Aufklärung der Tumorheterogenität am Beispiel von Knochen- und Weichteilsarkomen. Sie treten nahezu ausschließlich im Jugend- und jungen Erwachsenenalter auf und zeigen eine sehr stark ausgeprägte Tumorheterogenität, die eine Behandlung erschweren. Gleichzeitig weisen sie initial nur eine relativ geringe Anzahl an Veränderungen auf. Sie haben eine vergleichsweise geringe genetische Komplexität, was hilfreich ist, um Ereignisse oder Muster (z.B. das Einsetzen einer Therapieresistenz) deutlich zu erkennen. Das macht sie zu einem guten Modell, um den schrittweisen Erwerb genetischer und nicht-genetischer Veränderungen in den Tumorzellen nachzuzeichnen.
Ziel ist es, die Vorgänge bei der Entwicklung der Tumorheterogenität in diesen Krebsarten im Detail aufzuklären und bessere Behandlungsansätze zu entwickeln. Die Erkenntnisse sollen später auf andere Krebsarten mit stark ausgeprägter Tumorheterogenität übertragen werden.
2. Das Konsortium SATURN3
„Spatiale und Temporale Charakterisierung von intratumoraler Heterogenität in drei schwer behandelbaren Krebserkrankungen“
Hier steht die Erforschung der Details hinter der Resistenzentwicklung bei Brust, Darm- und Bauchspeicheldrüsenkrebs im Fokus. Die Forschenden planen, die räumliche und zeitliche Entwicklung der Tumorheterogenität im Detail nachzuvollziehen. Die Erkenntnisse sollen dazu dienen, Ansätze zu entwickeln, um die Therapiemöglichkeiten dieser bislang schwer behandelbaren Tumoren verbessern und damit die Überlebenschancen von betroffenen Menschen erhöhen zu können.
Fachübergreifende Zusammenarbeit, innovative Analysemethoden und Data Science
In jedem Verbund arbeiten große Teams disziplinübergreifend zusammen. Sie bearbeiten ihre Fragestellungen mit innovativen Methoden zur Analyse und nutzen auch Daten bzw. Proben aus anderen Studien, um die Veränderungen in den Tumorzellen auf vielfältigen Untersuchungsebenen zu erfassen und das molekulare Fortschreiten der Tumorentstehung zu rekonstruieren. Die umfassenden Ergebnisse aus den verschiedenen Quellen und Ebenen bringen sie zusammen und werten sie mithilfe maschineller Methoden aus.
Die Tumorheterogenität im Krankheitsverlauf
Die Forschenden greifen auf vorhandene Biodatenbanken zurück und analysieren Tumorproben, die zu verschiedenen Zeitpunkten der Erkrankung entnommen wurden. So wollen sie sehen, welche Veränderungen wann im Verlauf der Krankheit dazu kommen und das z.B. dem Einfluss der Therapie zuordnen.
Veränderungsprozesse in Tumoren und Metastasen räumlich nachverfolgen
Die Forschenden wollen auch nachvollziehen, welche Prozesse wann beim Fortschreiten von Tumorheterogenität in der Zelle ablaufen, wie das innerhalb der Zellen vermittelt wird und welche Faktoren (z.B. Einflüsse aus der Tumor-Mikroumgebung) das Geschehen im weiteren Verlauf beeinflussen.
Daher kommt auch innovative Molekulare Bildgebung zum Einsatz. Diese macht Stoffwechselprozesse und Eigenschaften des Tumormikromilieus innerhalb des Körpers sichtbar und stellt sie im räumlichen Verlauf dar.
An (Signal-)Proteine, die zu den individuellen Wachstumseigenschaften von Tumorzellen gehören, werden Marker gekoppelt, die sie in der Bildgebung sichtbar machen. So lässt sich sehen, in welchen Bereichen des Tumors bzw. den Metastasen sich das entsprechende Protein anhäuft. Daraus kann man Rückschlüsse über die in den unterschiedlichen Tumorzellklonen ablaufenden Signalwege und damit verbundene biologische Eigenschaften dieser Zellen/Zellklone ziehen.
Prozesse an künstlichen Minitumoren Schritt für Schritt verfolgen
Patientinnen bzw. Patienten können nicht dauerhaft mittels Bildgebung durchleuchtet werden, um den Krankheitsverlauf genau zu erfassen. Stellvertretend werden daher ebenso innovative „Organoid“-Modelle genutzt.
Das sind Minitumoren, die in der Petrischale aus den Krebszellen von Betroffenen herangezüchtet werden. So lassen sich aus vielen unterschiedlichen Tumorarealen generierte „Avatare“ der Tumoren gewinnen, an denen die biologischen Prozesse außerhalb des Betroffenen untersucht und zudem weitere Tests durchgeführt werden können.
Das ermöglicht noch viel umfassendere Möglichkeiten, die Ursachen und Zusammenhänge zwischen molekularen Mechanismen zu bestimmen, die für die Fortentwicklung der Erkrankung verantwortlich sind.
An den Organoiden lassen sich Einflüsse und Reaktionen der Zellen auf Behandlungsformen simulieren, beispielsweise Medikamente testen und einkreisen, welche Therapieform bei den vorliegenden Veränderungen am effektivsten ist – aber auch, inwieweit bestimmte eingesetzte Therapien womöglich zum Antreiber einer Resistenzbildung werden.
Big Data-Auswertung
Die Verarbeitung der anfallenden großen und komplexen Datenmengen erfolgt durch bioinformatische und maschinelle Methoden unter Einbezug Künstlicher Intelligenz. Dafür entwickeln die Wissenschaftlerinnen und Wissenschaftler neue Algorithmen und Methoden, um die Ergebnisse optimal computertechnisch auszuwerten.
Die ausgewählten Vorhaben sollen für einen Zeitraum von fünf Jahren mit einem Gesamtvolumen von mehr als 30 Millionen Euro gefördert werden.